■
A Neanderthal OAS1 isoform protects individuals of European ancestry against COVID-19 susceptibility and severity 「 nature medicine(Published: 25 February 2021)」より機械翻訳
ネアンデルタール人のOAS1アイソフォームは、COVID-19の感受性と重症度に対してヨーロッパ系の祖先を保護する。
/
抄録
コロナウイルス病2019(COVID-19)の感受性と重症度に影響を与える循環性タンパク質を同定するために、2サンプルのメンデル無作為化(MR)研究を実施し、逆因果関係や交絡因子によるバイアスを低減しつつ、数百種類の循環性タンパク質を迅速にスキャンした。最大14,134例と120万人の対照群において、OAS1レベルのs.d.増加はCOVID-19による死亡または人工呼吸の減少(オッズ比(OR)=0.54、P=7×10-8)、入院(OR=0.61、P=8×10-8)、および感受性(OR=0.78、P=8×10-6)と関連していることが明らかになった。504人のOAS1レベルを測定したところ、非感染状態の血漿OAS1レベルが高いほど、COVID-19の感受性および重症度の低下と関連していることが明らかになった。さらなる解析により、ヨーロッパ系の血統を持つ個体におけるOAS1のネアンデルタール人のアイソフォームが、このような保護作用を持つことが示唆された。このように、MRと症例対照研究から得られた証拠は、COVID-19の有害転帰におけるOAS1の保護的役割を支持している。OAS1レベルを増加させる利用可能な薬理学的薬剤は、医薬品開発のために優先的に使用される可能性がある。
Main
現在までに、COVID-19パンデミックは世界で200万人以上の死亡者を出し、約1億人が感染しています1。このような大流行の規模にもかかわらず、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)感染症の罹患率と死亡率を低下させるための疾患特異的治療法2は、現在のところほとんど存在しない。酸素依存症患者におけるデキサメタゾン療法3 を除けば、ほとんどの臨床試験では、ほとんどの場合、疾患転帰に対する効果は軽度か、あるいは一貫性がないことが示されています4,5,6。したがって、COVID-19の治療法開発には、有効なターゲットが必要である。
そのような標的の一つの源は、循環タンパク質である。最近の大規模プロテオミクスの進歩により、何千もの循環タンパク質の測定が可能となり、ヒト遺伝学からのエビデンスと組み合わせることで、そのようなターゲットは、医薬品開発の成功確率を大幅に向上させます7,8,9。デノボ医薬品開発には時間がかかるが、これらのタンパク質を標的とした現在利用可能な分子を再利用することで、患者に新しい治療法を提供する機会を加速できる可能性がある。
それにもかかわらず、交絡因子や逆因果関係が従来の循環蛋白質研究のバイアスになることが多いため、因果関係を解剖する方法が必要とされている。これは特にCOVID-19の場合であり、SARS-CoV-2への曝露が循環蛋白質レベルに大きな変化をもたらす10。 これらの限界に対処する一つの方法は、曝露(ここでは蛋白質レベル)が転帰(ここではCOVID-19転帰)に及ぼす影響を検定するために、器具変数として遺伝的変異体を使用する遺伝疫学的手法であるMRを使用することである。受胎時に対立遺伝子を無作為に割り当てるプロセスは、交絡によるバイアスを大幅に減少させる。遺伝子型は常に疾患発症前に割り付けられるため、MR研究は逆因果の影響を受けない。しかし、MR研究はいくつかの仮定11 に基づいており、最も問題となるのは、遺伝的手段の水平的多元性(遺伝子型が曝露とは無関係に転帰に影響を与える)である。このバイアスを回避するための一つの方法は、循環タンパク質をコードする遺伝子に隣接する循環タンパク質レベルに影響を与える遺伝的変異体を使用することである。それにもかかわらず、曝露と転帰との間の因果関係は、共局在化試験によって検出することができるリンケージ不平衡(LD)12によって混同される可能性がある。
感染症における循環蛋白質の病因的役割を理解することは困難である。 感染自体が循環蛋白質レベルの大きな変化をもたらすことが多いためである10。 したがって、サイトカインなどの循環蛋白質の増加が転帰の悪化と関連しているように見えるかもしれないが、実際にはサイトカインは感染に対する宿主の反応であり、転帰を緩和するのに役立っているかもしれない。したがって、非感染状態でのタンパク質レベルの遺伝的決定因子を特定することが重要であり、これはタンパク質レベルに対する人のベースラインの素因を反映していると考えられる。
MR研究は、COVID-19患者と対照群でタンパク質を縦断的に測定し、タンパク質レベルとCOVID-19の転帰との関連を推定することを可能にする従来の症例対照研究によって補完することができる。しかし、MR研究では、そのようなタンパク質の遺伝的決定因子を非感染者集団で測定した場合、非感染状態でのタンパク質の影響を予測する傾向がある。MR研究と症例対照研究は異なる仮定に依存しており、異なるバイアスの影響を受ける可能性があるため、2つの研究デザインの間で一致した結果は累積的なエビデンスを強化することができる13。
そこで本研究では、循環タンパク質レベルとCOVID-19の転帰に関する大規模なゲノムワイド関連研究(GWAS)の結果を組み合わせるために、2サンプルのMR解析と共局在化解析を行った14。我々はまず、大規模プロテオミクスGWASにおける循環タンパク質レベルの遺伝的決定因子を同定することから始め、次にMRを用いて、これらのcis-pQTLが大規模COVID-19 GWASにおけるCOVID-19転帰と関連しているかどうかを評価した。次に、リードタンパク質の発現QTL(eQTL)とスプライスQTL(sQTL)効果を調べた。次に、最も有望なタンパク質であるOAS1を、SARS-CoV-2感染が確認された個体において、感染中および感染後の縦断的サンプリングで追跡して測定した。
結果
cis-pQTLを用いたMRとプリーオトロピー評価
研究デザインを図1に示す。我々はまず、ヨーロッパ系の先祖を持つ個人を対象とした6つの大規模プロテオミクスGWAS(Sun et al.15 n = 3,301; Emilsson et al.16 n = 3,200; Pietzner et al.17 n = 10,708; Folkersen et al.18 n = 3,394; Yao et al.19 n = 6,861 and Suhre et al.20 n = 997)から、循環タンパク質レベルの遺伝的決定因子を入手することから始めた。これら6つの研究から得られた合計931個のタンパク質は、GenOMICCプログラム22の結果を含むCOVID-19 Host Genetics Initiative21のデータのメタアナリシスにおいて、ゲノム全体で有意なcis-pQTLまたは高度に相関したLDプロキシ(r2 > 0.8)を有していた。次に、1,425個のcis-pQTLと39個のLDプロキシを用いて、3つのCOVID-19転帰における循環タンパク質の遺伝的手段としてMR解析を行った。1) 非常に重度のCOVID-19疾患(死亡、機械的換気、非侵襲的換気、高流量酸素、または体外膜酸素療法の使用を経験した個体と定義される;99.7%はヨーロッパ人であった。 これらの患者の 99.7%はヨーロッパ系の祖先である)を用いて、4,336 例と 623,902 例の対照群;2)入院を必要とする COVID-19 疾患を用いて、ヨーロッパ系の祖先である 6,406 例と 902,088 例の対照群;および 3)COVID-19 の感受性を用いて、ヨーロッパ系の祖先である 14,134 例と 1,284,876 例の対照群を用いて、COVID-19 を発症した。すべての転帰において、症例はSARS-CoV-2感染の証拠を必要とした。非常に重症のCOVID-19および入院の転帰については、COVID-19の症例は核酸増幅または血清検査に基づいてSARS-CoV-2感染が実験室で確認されたものと定義した。COVID-19の感受性の転帰については、医療記録のレビュー(国際疾病分類(ICD)コードまたは医師のメモを使用)によっても症例が同定された。
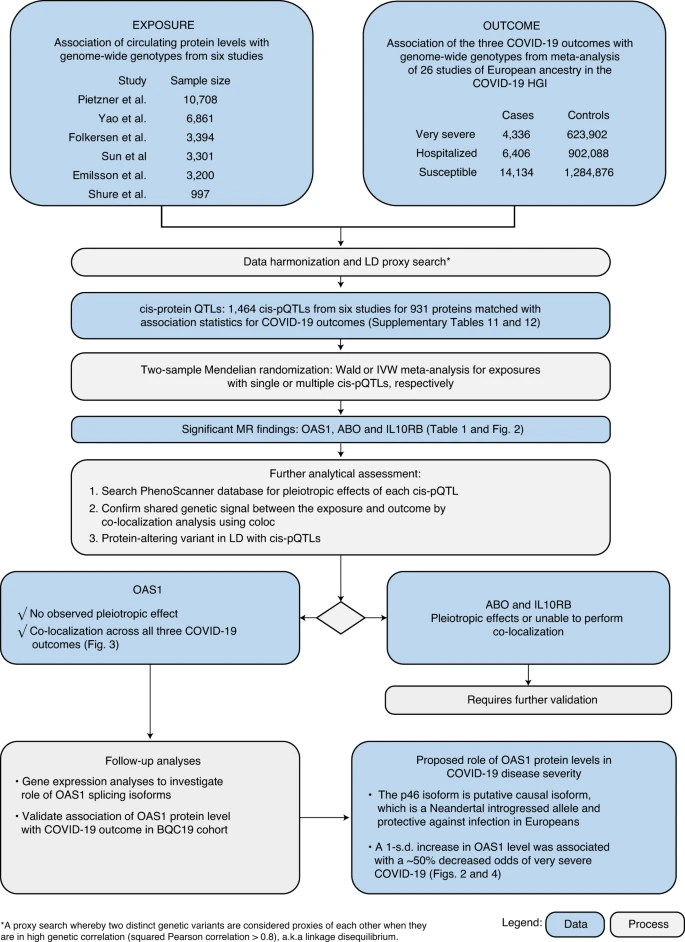
MR解析により、2′-5′オリゴアデニル酸合成酵素1(OAS1)、インターロイキン-10受容体βサブユニット(IL10RB)およびABOの3つの循環蛋白質のレベルが、Benjamini-Hochberg偽発見率補正後の少なくとも2つのCOVID-19転帰と関連していることが明らかになった(表1および補足表1-6)。特筆すべきは、OAS1レベルの増加は、3つのCOVID-19アウトカムすべてからの保護と強く関連していたことである。さらに、これらの効果の大きさは、より重度のアウトカムでより顕著であり、OAS1レベルの各s.d.の増加は、非常に重度のCOVID-19のオッズの減少と関連していた(OR = 0.54、95%信頼区間(CI))。 54、95%信頼区間(CI)0.44-0.68、P = 7.0×10-8)、入院(OR = 0.61、95%CI 0.51-0.73、P = 8.3×10-8)、および感受性(OR = 0.78、95%CI 0.69-0.87、P = 7.6×10-6)の減少と関連していた(図2a)。我々はまた、Emilssonら16およびPietznerら17において、OAS1レベルとの関連についてゲノムワイドな有意性を欠くために最初のMRには含まれていなかったOAS1のcis-pQTLを同定した16または彼らのCOVID-19発見パネル17には含まれていなかった。これらの追加のcis-pQTLを用いたMR解析では、一致した結果が得られた(補足表7)。
次に、OAS1レベルのcis-pQTL(rs4767027)がPhenoScanner23でカタログ化されている5,000以上の他の疾患、形質、またはタンパク質レベルと関連しているかどうかを評価したが、rs4767027は他の形質またはタンパク質レベルとは関連していなかった(P < 5.0×10-5)。これらの知見は、COVID-19の転帰に対するOAS1の効果のMR推定値が水平多値性によるものである可能性を減少させる。最後に、COVID-19感受性を除いて、rs4767027の効果は、COVID-19宿主遺伝学イニシアティブのGWASメタアナリシスにおいて不均一性の証拠を示さなかった(表1)。
IL10RBのcis-pQTL(rs2834167)を用いて、我々は、循環IL10RBレベルの1-s.d.の増加が、非常に重篤なCOVID-19(OR = 0.47、95%CI 0.32-0.68、P = 7.1×10-5)および入院(OR = 0.53、95%CI 0.39-0.73、P = 8.8×10-5)のオッズの減少と関連しているが、感受性の減少とは関連していないことを見出した(図2a)。PhenoScannerを用いて、IL10RBに対するcis-pQTLのプリーオトロピック効果の証拠を見いだせなかった。循環ABOレベルの1-s.d.の増加は、COVID-19の不利な転帰のオッズの増加と関連していた(表1);しかしながら、ABOのcis-pQTL(rs505922)は、他のいくつかのタンパク質のレベルと強く関連しており、潜在的な水平的な多相性効果を示唆していることがわかった(補足表8)。ABOが複数の生理学的プロセスに関与していることが知られていることを考えると、これらの結果は予想通りであったが、MR解析では水平多値化の影響による著しいバイアスを受ける可能性があることを強調している。
共局在化研究
LDによる交絡がCOVID-19転帰に対する循環OAS1の推定効果に影響を与えているかどうかを検証するために、coloc12で実装されている共局在化解析を用いて、OAS1の循環タンパク質レベルの遺伝的決定因子が3つのCOVID-19転帰と共有されている確率を検証した。OAS1レベルとCOVID-19転帰がcis-pQTLであるrs4767027の1-Mb遺伝子座における単一の因果関係シグナルを共有する事後確率は、重度のCOVID-19では0.72、COVID-19による入院では0.82、COVID-19感受性では0.89であった(図3)。この共局在化の結果は、Pietznerら17によって同定されたOAS1 cis-pQTLを用いても再現された(補足表7)。このことは、OAS1の循環タンパク質レベルとCOVID-19の転帰には、単一の共有された因果関係シグナルが存在する可能性が高いことを示唆している。
ABOレベルと異なるCOVID-19アウトカムの共局在化もまた、ABOレベルと異なるCOVID-19アウトカムの共局在化を示した(ABOレベルと非常に重度のCOVID-19、COVID-19による入院、および感受性については、それぞれ単一の共有シグナルの事後確率=0.90、0.98、および1)(拡張データ図1)。IL10RBについては、オリジナルのプロテオミクスGWAS16のゲノムワイドサマリーレベルのデータが不足していたため、共局在化解析を行うことができませんでした。
アプタマー結合効果
タンパク質改変変異体(PAV)15は、タンパク質レベルを定量するために使用されるアプタマーや抗体などのアフィニティー剤の結合に影響を与える可能性がある。そこで我々は、MR優先タンパク質のcis-pQTLがPAVであるか、あるいはPAVを持つLD(r2 > 0.8)であるかどうかを評価した。rs505922(ABO)は既知のミスセンスバリアントでLDにはなく、rs4767727(OAS1)はイントロニックバリアントであり、ヨーロッパ系祖先のミスセンスバリアントrs2660(r2=1)でLDにある。しかし、RNA配列決定に由来する発現研究は、アプタマー結合に影響を与えうるミスセンスバリアントの潜在的な影響を受けないため、次に、rs4767027がOAS1の発現および/またはスプライシングにも影響を与えるかどうかを探った。
OAS遺伝子のsQTLおよびeQTL研究
sQTLとは、タンパク質の異なるアイソフォームの転写に影響を与える遺伝的変異のことである。OAS1を標的とするアプタマーは、NP002525.2のアミノ酸配列1-364からなる合成タンパク質に対して開発されましたが、これは2つの主要なOAS1アイソフォームであるp46とp42に共通しています。rs10774671はOAS1の既知のsQTLであり、交互スプライシングを誘導してp46とp42のアイソフォームを形成する。ヨーロッパ系の先祖代々の現代人のほとんどは、代替バリアント(rs10774671-A)を持っています。先祖代々の変異体(rs10774671-G)は、アフリカの集団における主要な対立遺伝子であり、ネアンデルタール人およびデニソバン人ゲノム24,25で固定化された。しかし、p46アイソフォームの発現が増加した先祖代々の変異体は、ネアンデルタール人からの遺伝子の流れを介してヨーロッパの集団に再導入された26。以前の解析では、rs10774671のGGまたはGA遺伝子型のいずれかを持つ個体は、循環血液中に見られる優勢なアイソフォームでもあるp46の発現量が高いことが示唆されています27。抗ウイルス活性の違いがアイソフォーム間で観察されており、p46は特定のウイルス感染症でより活性である28。興味深いことに、OAS1 pQTL rs4767027は、ヨーロッパの集団では、rs10774671(参考文献26)と高いLD(r2 = 0.97)にあります。機能研究は、rs10774671のG対立遺伝子がp46アイソフォームの発現を増加させるが、p42アイソフォーム27の発現を減少させることを支持している。sQTL rs10774671のこのG対立遺伝子は、pQTL rs4767027のT対立遺伝子を反映しており、それ自体が測定されたOAS1レベルの上昇、およびCOVID-19の重症度および感受性のオッズの低下と関連している。これらの別個の証拠は、SomaScanプラットフォームで測定されたOAS1レベルは、COVID-19の転帰から保護する可能性のあるp46アイソフォームを主に同定していることを示唆している。
OAS1スプライシングのMR研究を行ったところ、p46アイソフォームの発現の増加(LeafCutter29,30によって定義されたイントロンクラスターの正規化されたリードカウントによって定義される)がCOVID-19転帰のオッズの減少と関連していることがわかりました(OR = 0.17, 29, 95% CI 0.17, 0.17, 0.17, 0.17)。 29、95%CI 0.17-0.49、感受性についてはP = 4.1×10-6、入院についてはOR = 0.09、95%CI 0.04-0.21、P = 2.0×10-8、非常に重篤なCOVID-19についてはOR = 0.05、95%CI 0.02-0.13、P = 3.1×10-9)と関連していた。) 図2b)。また、共局在化解析では、OAS1、pQTL、COVID-19アウトカムについてのsQTL間での因果関係シグナルの共有も支持されました(拡張データ図2)。興味深いことに、共局在化解析では、pQTLよりもsQTLとの共有シグナルの確率が高く、p46アイソフォームがOAS1レベルとCOVID-19アウトカムとの関連のドライバーである可能性を示唆しています。
次に、我々はeQTL MR解析を用いて、アイソフォームに関係なくOAS1レベルの発現の増加がCOVID-19転帰と関連しているかどうかを検証した。その結果、GTEx v8(参考文献31)から、総OAS1のeQTLであるrs10744785を同定した。総OAS1発現レベルはCOVID-19感受性および入院とは関連していませんでした(図2b)。また、全血中のOAS3発現量の増加が、MR解析においてCOVID-19の転帰と正の相関を示し、それらの遺伝的シグナルの共局在化を支持することを発見した(拡張データ図3 nd補足表9)。
これらのpQTL、sQTLおよびeQTL研究をまとめると、OAS1のp46アイソフォームのレベルの増加がCOVID-19の有害転帰から保護するようであることが示唆される。
測定されたOAS1タンパク質レベルとCOVID-19の転帰との関連性
MR研究は非感染状態で測定されたタンパク質レベルに由来するため、非感染状態でのOAS1タンパク質レベルの上昇がCOVID-19転帰のオッズ低下と関連するという仮説を検証した。そのために、COVID-19感染中に複数の時点で採取されたポリメラーゼ連鎖反応(PCR)によりSARS-CoV-2陽性と判定された399人の患者と、COVID-19症状を呈したがSARS-CoV-2 PCR鼻腔粘膜が陰性であった105人のCOVID-19コホート(Biobanque Quebecoise de la COVID-19 cohort)(www.BQC19.ca)から採取された縦断的検体1,039検体を対象に、SomaScanプラットフォームを用いてOAS1タンパク質レベルを測定するケースコントロール研究を実施した。SARS-CoV-2感染の鼻腔スワブを受けた個人をプロスペクティブに募集した(表2)。
非感染性検体を、症状発症から少なくとも 31 日後に SARS-CoV-2 を発症した回復期患者から採取した検体(n = 115)、または PCR で SARS-CoV-2 が陰性であった患者から採取した検体(n = 105)と定義した。また、SARS-CoV-2が陽性の患者から採取したサンプルを持つ個人(n = 313)でOAS1レベルを測定したところ、感染中にOAS1レベルの上昇が認められました(拡張データ図4-6)。OAS1レベルは、感染していないサンプルでは年齢および性別と関連していなかった(拡張データ図7)。サンプルの品質管理(Methods)後、感染中に収集された少なくとも1つのサンプルを有する患者308人、非感染状態で収集された少なくとも1つのサンプルを有する患者113人、およびCOVID-19陰性の対照103人を分析に含めた(拡張データ図8)。
非感染状態でのOAS1レベルがCOVID-19の転帰と関連しているかどうかを検証するために、年齢、性別、年齢*、プレート、リクルートセンター、およびサンプル処理時間を制御してロジスティック回帰を行った。OAS1レベルを対数変換し、MR試験の変換手順に合わせて標準化した。非感染性サンプルでは、対数変換スケールでのOAS1レベルの各s.d.増加は、COVID-19転帰の減少オッズと関連していることがわかった(OR = 0.20、95%CI 0.08~0.53、P = 0.001、重度のCOVID-19転帰の場合は0.00~0.001)。 非常に重度のCOVID-19については0.001、入院についてはOR = 0.46、95%CI 0.28-0.76、P = 0.002、および感受性についてはOR = 0.69、95%CI 0.49-0.98、P = 0.04)(図4、拡張データ図9および補足表10)。これらの結果は、非感染状態での循環OAS1レベルの増加が、これらすべてのCOVID-19の有害な転帰に対する保護と関連していたMRからの知見と一致している。
活動的な感染状態で採取されたサンプルでは、OAS1レベルの増加がCOVID-19の有害転帰のオッズの増加と関連していることがわかった(非常に重度のCOVID-19ではOR = 1.50、95% CI 1.19-1.90、P = 0.0007、入院ではOR = 1.93、95% CI 1.46-2.56、P = 4.8×10-6、感受性ではOR = 4.39、95% CI 2.87-6.73、P = 1.09×10-11)(図4)。
これらの知見をまとめると、非感染状態でのOAS1レベルの上昇はCOVID-19の良好な転帰と関連しており、感染中にSARS-CoV-2に曝露されると、OAS1レベルを上昇させることが知られているインターフェロン経路が刺激されるため、OAS1レベルが上昇する可能性が高いことが示唆された32。
議論
COVID-19転帰に関連する罹患率と死亡率を減少させるためには、疾患特異的な治療法が必要である。ヨーロッパ系の先祖を持つ最大14,134例と120万人の対照者を対象に、3つのCOVID-19転帰について評価した931個のタンパク質について、2サンプルの大規模MR研究を行ったところ、非感染状態でのOAS1レベルの上昇が、重症COVID-19、入院および感受性のリスク低下と強く関連していることが示された。保護効果の大きさは特に大きく,OAS1の循環レベルがs.d.増加するごとに重症COVID-19のオッズが50%減少することが観察された.OASタンパク質は、RNAウイルスに対する自然免疫応答の一部である。これらのタンパク質はインターフェロンによって誘導され、潜伏RNase Lを活性化し、in vitroでの研究で実証されたように、ウイルスおよび内因性RNAの直接的な破壊をもたらします33。したがって、OAS1はSARS-CoV-2に対する生物学的活性を有している。OAS1を活性化する治療法が存在するため、COVID-19の潜在的な治療法として再配置することが優先されるべきである。
サハラ以南のアフリカ以外の集団では、rs4767027-T(OAS1のpQTL)とrs10774671-G(OAS1のsQTL)の両方の保護対立遺伝子は、ネアンデルタール人のハプロタイプ34で発見され、それは〜5万〜6万年前に現代人に引き継がれた35。この遺伝子座でネアンデルタール人から以前に記載された遺伝子の流れ35とGWAS22でCOVID-19に対する保護に関連付けられたハプロタイプとの間の対応は、最近実証された34。これら2つの一塩基多型(SNP)はハプロタイプを共有しているにもかかわらず、それらの進化の歴史は異なっている。rs4767027-T対立遺伝子はネアンデルタール人の系統に由来するのに対し、rs10774671-G対立遺伝子はネアンデルタール人が先祖代々の状態を保持していた。rs10774671-G対立遺伝子によって制御されたOAS1代替スプライシングは、p42アイソフォーム36よりもウイルスに対して高い酵素活性を持っており、感染時に堅牢にアップレギュレートされた唯一のOAS1アイソフォームであるp46を増加させる26。OAS1に対するpQTLとsQTLの機能的関連性を完全に解明するためにはさらなる研究が必要であるが、遺伝子産物の抗ウイルス活性は、ヨーロッパ人の共通ハプロタイプよりもネアンデルタール人のハプロタイプの方が高い28。ヨーロッパ人では、ネアンデルタールのハプロタイプは正の選択を受けており26、rs4767027-T対立遺伝子は対立遺伝子頻度0.32に達している。MRと循環タンパク質の測定を用いて、我々はここで、ヨーロッパ系の現代人におけるネアンデルタール型ハプロタイプのOAS1レベルの増加が、このような保護効果をもたらすことを実証した。
MRによる証拠は、SomaScanアッセイで測定されたOAS1のp46アイソフォームレベルの上昇とOAS1の総タンパク質レベルの上昇が、COVID-19の転帰に対して保護効果を持つことを示した。これらの結果は共局在解析によって強く支持された。OAS1のsQTLとpQTLの間の一貫した共局在化、OAS1のeQTLとpQTLの間の共局在化の欠如、およびSomaScanアッセイがp46アイソフォームを測定している可能性が高いという証拠を考えると、OAS1の保護効果はp46アイソフォームに由来している可能性が高いと思われる。しかしながら、循環中の各アイソフォームを特異的に測定するためにはさらなる調査が必要であり、COVID-19の転帰に対してOAS1の総量よりもむしろp46アイソフォームの方が最も保護効果が高いかどうかをよりよく理解するためには、アイソフォーム活性アッセイが必要であろう。
より活性の高いp46アイソフォームをコードする先祖代々のOAS1スプライスバリアントは、アフリカを離れた現代人の間で失われた。この機能喪失を説明するにはいくつかのシナリオが考えられるが、例えば、アフリカからの脱出の際の浄化選択の喪失は、環境病原体の変化や、OAS1の抗ウイルス活性によって誘発される潜在的な害によるものかもしれない37。残念ながら、サハラ以南のアフリカ人におけるOAS1 p46祖先対立遺伝子がCOVID-19に対する保護を提供するかどうかを検証するのに十分なデータがない。それにもかかわらず、これらの知見は、COVID-19のリスク調節におけるネアンデルタール人ゲノムの重要性をさらに強調している。なぜなら、3番染色体上のリスク遺伝子座はネアンデルタール人からの遺伝であることも報告されているからである38。
OAS1、OAS2およびOAS3はかなりの相同性を共有している。インターフェロン刺激遺伝子39として、OAS1の多型は、いくつかのクラスのウイルス感染に対する宿主免疫応答と関連している40,41,42,43,44。OAS1がウイルスRNAの分解を導くRNase Lを活性化する細胞内酵素であることを考えると、この酵素の循環レベルはこのタンパク質の細胞内レベルを反映している可能性が高い。しかし、細胞外OAS1はまた、ウイルス免疫応答33で重要であるかもしれないという実験的証拠がある。
OAS1発現に影響を与えることができる分子は現在存在する。OAS1発現の増加につながるサイトカインカスケードを活性化するインターフェロンβ-1b45は、現在、多発性硬化症の治療に使用されており、血球中のOAS1発現を誘導することが示されている46。インターフェロンをベースとした治療は、他のウイルス感染症でも使用されている47。しかし、最近の無作為化試験では一貫性のない結果が示されている。インターフェロンβ-1bの静脈内投与とロピナビル・リトナビルの併用はMERS-CoV感染症による死亡率を減少させたが48、非盲検試験であるSOLIDARITY試験49ではインターフェロンβ-1bの静脈内投与の有用性は示されなかった。一方、最近行われた第2相試験では、吸入式ネブライザー式インターフェロンβ-1a(インターフェロンβ-1bと密接に関連している)の効果を試験したところ、治療群でCOVID-19症状の改善が認められた50。この試験では、死亡率に差を示すためのパワーが与えられていなかったが、すべての死亡はプラセボ群で発生した。ネブライジングされたインターフェロンβを吸入すると、肺での組織利用率が格段に高くなり、抗ウイルス活性の改善につながる可能性がある。さらに、プロ炎症性サイトカインを投与しても、炎症が主導する疾患の段階では効果が得られない可能性があるため、投与のタイミングが重要な役割を果たしていると考えられる。しかし、SOLIDARITY試験では、投与時期に関するデータが現時点では得られておらず、結論を出すことはできない。最後に、インターフェロン補充の効果は先祖代々の集団によって異なる可能性があり、祖先によってOAS1のより活性の高いp46アイソフォームの量が異なるためである。我々の研究は、p46アイソフォームの発現量が多いヨーロッパ系の集団に限定されていた。興味深いことに、SOLIDARITY試験では患者の78%が南アジア、中東、北アフリカ、ラテンアメリカに登録されており、これらの地域ではp42 OAS1アイソフォームの発現が高い可能性があります。インターフェロンβ-1bは、異なる祖先の集団では遺伝的変異の頻度が異なるため、異なる効果を示す可能性があります。
OAS1によって合成された2′-5′オリゴアデニル酸を分解するホスホジエステラーゼ12を薬理学的に阻害することで、OASが媒介する抗ウイルス活性が増強されるというin vitroの証拠があります51,52。興味深いことに、SARS-CoV-2と同じファミリーのコロナウイルスは、2-5′-オリゴアデニル酸を分解し、RNase-L活性を低下させるウイルスタンパク質を産生し、宿主免疫応答の回避につながることが示されている53,54。我々の知見は、SARS-CoV-2がOAS1関連の抗ウイルス防御に敏感な状況があることを示す最近の実験研究55とも一致している。我々の知見は、OAS1のレベルまたは活性を増加させる薬理学的戦略、および細胞外OAS1の抗ウイルス活性の可能性についての更なる評価を動機づけるものである(参考文献33)。したがって、OAS1レベルの増加につながる既存の前臨床分子51を最適化し、COVID-19のアウトカムへの影響について試験することができる。
我々のMR解析では、OAS3の発現レベルが高いとCOVID-19の転帰が悪くなることがわかったが、これはOAS1と比較して逆方向の効果である。OAS1とOAS3に対するp46アイソフォームの不調和な効果は、以前の研究でも報告されています26が、これは自然免疫応答に関わるOAS遺伝子の複雑な生物学を反映しているのかもしれません。GenOMICCプログラムからの最近の転写ワイド関連研究22では、肺および全血中のOAS3の高発現が遺伝的に予測され、COVID-19患者が重症化するリスクの高さと関連していた。SARS-CoV-2に特異的なOAS遺伝子の役割を評価するためのさらなる研究が必要であるが、OAS遺伝子の抗ウイルス効果を示す以前の機能的研究26を考えると、COVID-19の転帰に対するp46アイソフォームの保護効果の主な推進因子はOAS1である可能性が高い。
この研究には限界があった。第一に、我々は非感染状態で測定した循環タンパク質レベルの影響をテストするためにMRを使用したが、なぜなら、循環タンパク質に対するcis-pQTLの影響はSARS-CoV-2に曝露されていない個体で推定されたからである。人がSARS-CoV-2に感染すると、循環タンパク質のレベルが変化する可能性があり、これは特にIL10(IL10RBに結合する)やOAS1などのサイトカインに関連している可能性がある。したがって、本論文で示されたMRの結果は、非感染状態で測定した場合の循環タンパク質レベルの影響を推定したものと解釈すべきである。継続的な研究は、同じcis-pQTLが感染時の循環タンパク質レベルに影響を与えるかどうかを明らかにするのに役立つであろう。第二に、この種の研究では、高い偽陰性率に悩まされる。私たちの目標は、COVID-19の結果に影響を与えるすべての循環タンパク質を特定することではなく、むしろ、強いcis-pQTLを持ついくつかのタンパク質についてのエビデンスを提供することであった。今後、より多くの循環蛋白質を適切にアッセイした大規模なプロテオミクス研究を行うことで、これらの限界を克服することができるはずである。第三に、ほとんどのMR研究は曝露と転帰の間に直線的な関係があると仮定している。したがって、我々の所見では、COVID-19の転帰への影響が明確な閾値効果を持つタンパク質を同定することはできないだろう。第四に、RNAシークエンシングで測定されたOAS1レベル(p46だけではない)は、オルタナティブスプライシングの影響で偏っている可能性があり、COVID-19に対する保護におけるOAS1のシスpQTLの関連で示されたOAS1とOAS3レベルの役割は、可能性があるが、まだ検討されていない。また、OAS1レベルの測定がアプタマー結合効果に影響される可能性を完全に排除することはできなかった。最後に、本論文で紹介したデータはすべてヨーロッパ系の個人のみを対象としたものであり、他の集団における遺伝子型解析の重要性を改めて強調するものである。
結論として、我々は大規模研究から得られた循環タンパク質レベルの遺伝的決定因子とCOVID-19の転帰を用いて、OAS1がCOVID-19の感受性と重症度に対する保護効果を有するという説得力のある証拠を発見した。ケースコントロール研究で血漿OAS1レベルを測定したところ、非感染状態でのこのタンパク質の循環レベルが高いほど、COVID-19の有害な転帰のリスク低下と強く関連していることが明らかになった。興味深いことに、利用可能な証拠は、ヨーロッパ系祖先の個人におけるOAS1による保護効果が、ネアンデルタール人が侵入したp46 OAS1アイソフォームによるものである可能性が高いことを示唆している。OAS1レベルを増加させる既知の薬理学的薬剤51 は、COVID-19転帰への影響について検討される可能性がある。
方法
pQTL GWAS
我々は、6つの大規模なプロテオミクスGWAS15,16,17,18,19,20から体系的にpQTL関連を同定した。これらの研究はそれぞれ、SomaLogic SomaScansまたはO-link proximal extension assaysのいずれかを使用してプロテオミクスプロファイリングを行った。
COVID GWASおよびCOVID-19の結果
cis-pQTLとCOVID-19の転帰との関連を評価するために、COVID-19宿主遺伝学イニシアティブ21のCOVID-19メタ解析GWAS(データフリーズ4)を使用した。我々の研究では、これらのGWASメタ解析のうち3件を使用したが、その中にはヨーロッパ系祖先の25コホートとアメリカ系祖先の混血1コホートが含まれていた。試験した転帰は、重症COVID-19、COVID-19による入院、COVID-19に対する感受性(COVID-19宿主遺伝学イニシアティブではそれぞれA2、B2、C2と名付けられている)であった。
非常に重篤なCOVID-19症例は、COVID-19を入院の主な理由として、実験室で確認されたSARS-CoV-2感染(核酸増幅検査または血清学に基づく)および死亡または呼吸サポート(侵襲的人工呼吸、持続的正気道圧、バイレベル正気道圧または持続的外陰圧、高流量鼻腔酸素またはフェイスマスク酸素)を有する入院患者と定義された。単純な補助酸素(例えば、鼻カニューレを介した2L min-1)は症例の状態には該当しなかった。対照群は、この症例定義を満たさなかった参加コホートのすべての個人であった。
COVID-19入院症例は、COVID-19に関連した症状のために入院した、実験室で確認されたSARS-CoV-2感染(非常に重篤な表現型と同じ微生物学的手法を用いて)で入院した個人として定義された。対照群は、この症例定義を満たさなかった参加コホートのすべての個人であった。
COVID-19症例の感受性は、実験室で確認されたSARS-CoV-2感染、COVID-19の健康記録上の証拠(ICDコーディングまたは医師による確認)、または自己申告による感染(例えば、質問票による)を有する個人として定義された。対照群は、この症例定義を満たしていないすべての個人とした。
2サンプルMR
我々は、2サンプルMR解析を用いて、COVID-19の転帰に影響を及ぼす潜在的な循環タンパク質をスクリーニングし、その役割を検証した。2サンプルMRでは、曝露と転帰に対するSNPの影響を別々のGWASから取得する。この方法は、曝露と転帰のGWASのサンプルサイズを大きくすることができるため、しばしば統計的な力を向上させることができる56。
暴露の定義。6つの大規模プロテオミクスGWAS研究15,16,17,18,19,20を用いてMRを実施した。Sunら、Emilssonら、Pietznerらの循環タンパク質はSomaLogicプラットフォームで測定した;Suhreら、Yaoら、FolkersenらはO-linkプラットフォームでのタンパク質測定を使用した。COVID-19の転帰への影響を調べるために、cis-pQTLのみを有するタンパク質を選択したが、これは潜在的な水平多元性の影響を受ける可能性が低いためである。cis-pQTLは、測定されたタンパク質9をコードする遺伝子の転写開始部位から1Mb以内に最も低いP値を持つゲノム全体で有意なSNP(P < 5×10-8)と定義した。Emilssonら、Pietznerら、Suhreら、Yaoら、およびFolkersenらからのタンパク質については、これらのデータが利用可能であったため、研究ごとにタンパク質ごとのセンチネルcis-pQTLを使用した。Sunらからのタンパク質については、PLINK 1.9(参考文献57)および1000 Genome58ヨーロッパ集団参照パネルを使用して、各SOMAmer結合タンパク質について報告されている要約統計量から最も低いP値を持つLD非依存性cis-pQTL(r2 < 0.001、距離1,000kb)をクランプして選択した。所見を横断的に検討するために、異なる研究から得られた異なるcis-pQTLで表される同一のタンパク質を含めた。COVID-19 GWASに存在しないcis-pQTLについては、LD r2 > 0.8でマイナー対立遺伝子頻度(MAF)< 0.42のSNPをプロキシとして選択した;MAF > 0.3をプロキシSNPの対立遺伝子アライメントに使用した;パリンドロミック効果を持ち、MAF > 0.42のcis-pQTLは、対立遺伝子のミスマッチを防ぐためにMRの前に除去した。MRを用いてテストしたタンパク質の総数をコントロールするためにBenjamini-Hochberg補正を使用した。MR分析は、R59のTwoSampleMRパッケージを使用して実施した。単一の(センチネル)cis-pQTLを持つタンパク質については、3つのCOVID-19の結果のそれぞれに対する各循環タンパク質の効果を推定するためにWald比を使用した。複数の独立したcis-pQTLを持つ任意のタンパク質/SOMAmer試薬については、それらの複合効果をメタ分析するために逆分散重み付け法を使用した。COVID-19 GWASでタンパク質のcis-pQTLを調和させた後、Sunらの合計566個のSOMAmer試薬(529個のタンパク質、565個の直接一致cis-pQTLおよび26個のプロキシ)、Emilssonらの760個のタンパク質(747個の直接一致cis-pQTLおよび11個のプロキシ)、Pietznerらの91個のタンパク質(90個の直接一致cis-pQTLおよび2個のプロキシ)を用いて、SOMAmer試薬の効果をメタ分析した。Suhreらによる74個のタンパク質(直接一致した72個のcis-pQTL)、Yaoらによる24個のタンパク質(直接一致した24個のcis-pQTL)、Folkersenらによる13個のタンパク質(直接一致した13個のcis-pQTL)を、3つのCOVID-19アウトカム(補足表11および12)15,16,17,18,19,20のMR解析のための装置として使用した。
プレオトロピー評価
MR の一般的な落とし穴は、遺伝的変異が曝露とは独立した経路を介して転帰に影響を与える場合に発生する水平多値性である。循環タンパク質のcis-pQTLを使用することで、上記の理由から多値化の可能性を大幅に減らすことができます。我々はまた、他の循環タンパク質とのcis-pQTLの関連性(すなわち、他のタンパク質へのtrans-pQTLであったり、他の無関係な疾患や形質と有意に関連している場合)を調べることにより、MR優先タンパク質のcis-pQTLのプリーオトロピー効果の可能性を評価するために、これまでに行われた5,000件以上のGWASを含む、観察されたSNPと結果の関連性の大規模なカタログであるPhenoScanner23データベースを検索した。SomaLogicプラットフォーム上で測定されたMR優先タンパク質のcis-pQTLについて、我々は潜在的なアプタマー結合効果(PAVの存在がタンパク質測定に影響を与える可能性がある)の可能性を評価した。また、各COVID-19アウトカムGWASにおいて、MR優先タンパク質のcis-pQTLがCOVID-19集団間で有意に不均一な関連を有するかどうかを確認した。
共局在化解析
次に、LDによる交絡の可能性を評価する共局在化解析を用いて、循環タンパク質の遺伝的シグナルとCOVID-19の3つのアウトカムのそれぞれの共局在性を検証した。具体的には、ゲノム全体のサマリーデータが利用可能なMR重要タンパク質のそれぞれについて、プロテオミクスGWASについては、cis-pQTLを中心とした1MBのゲノム遺伝子座のすべてのバリアントを解析するために、coloc12 Rパッケージを用いて厳格なベイズ解析を実施した。仮説4(PP4、蛋白質レベルとCOVID-19の結果の両方に関連性があり、それらは同じ原因バリアントによって駆動される)の事後確率が0.5以上の共局在は共局在する可能性が高いと考えられ(これはcolocの5つの仮説すべてにおいて最高の事後確率を意味する)、PP4 > 0.8は共局在する可能性が高いと考えられた。
OAS遺伝子のsQTLおよびeQTL MRと共局在化研究
全血中のOAS遺伝子の発現と代替スプライシングの影響を理解するために、GTEx project v8 (ref. 31)のGWAS要約データを用いて、MRおよび共局在化解析を行った。遺伝的手段は、GTEx31のステップワイズ回帰を用いて同定したOAS1のsQTLとeQTL、およびOAS2とOAS3のeQTLを条件付き独立(r2 < 0.001)とした。OAS1のsQTL SNP(rs10774671)は、もともとGTEx30において、p46アイソフォームの最後のイントロン(chr12:112,917,700-112,919,389、GRCh38)のLeafCutter29クラスターの正規化されたリードカウントに対して同定されたものであり、p46アイソフォームの影響を推定するために使用されました。共局在化解析は、GTExからのGWAS要約統計を用いて、各QTLの1Mb以内の領域に限定して行った。
BQC19におけるCOVID-19転帰に関連する血漿OAS1タンパク質レベルの測定
BQC19は、COVID-19病の原因と結果に関する研究を可能にするためのケベック州全体のイニシアチブである。本研究に参加した患者は、カナダのケベック州モントリオールにあるユダヤ人総合病院(JGH)およびモントリオール大学センター(CHUM)で募集された。
COVID-19の症例対照状態は、MRの結果が導き出されたCOVID-19宿主遺伝学イニシアティブのGWAS研究と一致していると定義した。すなわち、非感染段階から採取したサンプルと感染の急性期に採取したサンプルの両方において、OAS1タンパク質レベルと3つの異なるCOVID-19アウトカムの定義との関連性を検証した。3つのアウトカムは以下の通りであった。1) 非常に重篤なCOVID-19とは、実験室で確認されたSARS-CoV-2感染(核酸増幅検査または血清学に基づく)と死亡または呼吸サポート(侵襲的人工呼吸器、持続的陽圧気道圧、バイレベル陽圧気道圧または持続的外陰圧、高流量鼻腔酸素または顔面マスク酸素)を有する入院患者と定義された。対照群は、この症例定義を満たさなかったすべての患者とした。2) COVID-19入院症例-検査室でSARS-CoV-2感染が確認された入院患者として定義された。対照群は、この症例の定義を満たしていないすべての患者であった。3) COVID-19症例は、実験室でSARS-CoV-2感染が確認された症例と定義し、対照はSARS-CoV-2のPCR検査を受けたが陰性であったすべての症例とした。COVID-19を有する患者の症状発現日は、患者カルテから収集したか、またはCOVID-19検査がない場合は最初のCOVID-19陽性から推定した。症例の包含基準は排他的ではなかった。つまり、感受性解析で症例とされた一部の患者は、症例の定義を満たしていれば、入院および重症のCOVID-19コホートにも含まれていた。
合計125人がCHUMから、379人がJGHから募集された。個人は最大5つの異なる時点で採血を行った(200人が1回の測定、113人が2回の測定、152人が3回の測定、38人が4回の測定、1人が5回の測定)。症状発症からの日数(T1)は、症状発症日および採血日に基づいて、各検体について計算した。COVID-19が陰性であった個体については、T1を0に設定した。 各検体の検体処理時間(時間単位)もまた、検体処理時間の延長による細胞溶解から放出されるタンパク質量の増加を考慮して、検体採取から処理までの時間を測定するために計算した。
シト化(ACD)血漿サンプル中のタンパク質レベルは、SomaScanアッセイを用いて測定した。SARS-CoV-2 陽性患者 399 例、および主にヨーロッパ系の SARS-CoV-2 陰性患者 105 例の合計 1,039 サンプルが SomaScan アッセイを受け、4,742 個のタンパク質を標的とした 5,284 種類の SOMAmer 試薬が含まれていました。SomaScanアッセイでは、特定のタンパク質標的に選択的に結合するように設計された一本鎖DNAアプタマー(「SOMAmer」)を使用しています60。SOMAmer試薬の結合は、マイクロアレイによって定量され、相対蛍光単位(RFU)の豊富さを測定します。各タンパク質のRFUは、ハイブリダイゼーション制御、プレート内中央値信号の正規化、プレートのスケーリングとキャリブレーション、全サンプルの内部データから生成された基準への中央値信号の正規化を含む4つの正規化プロセスを受けた。すべての正規化はSomaLogic社によって実施され、同社のテクニカルノート61に詳細が記載されています。
SARS-CoV-2陽性の患者のうち、感染状態にある患者から採取されたサンプルを、症状の最初の日から14日以内(14日目を含む)に採取されたサンプルと定義した62。症状発症から14日以内に複数の検体を採取した患者については、最も早い検体を使用した。非感染性の患者から採取した検体を、症状発症から少なくとも31日後に採取したSARS-CoV-2陽性患者からの検体と定義した。31日目を選択したのは、最近のシステマティックレビューにおけるSARS-CoV-2陽性の持続期間の四分位の範囲の上限であり、BQC19(参考文献63)における最初に予定されている外来でのフォローアップ血液検査と一致していたからである。症状発症から少なくとも 31 d 後に 1 つ以上のサンプルがある個人については、最新のサンプルを使用した。
OAS1レベルは、1つのSOMAmer試薬(OAS1.10361.25)で測定した。各群内で、シグナル正規化されたOAS1レベルの中央値を自然対数変換し、サンプル処理時間で調整し、残差をさらに標準化した。各グループについて、長いサンプル処理時間(サンプル処理時間>50時間)または高いOAS1レベル(対数OAS1レベル>8)を有する外れ値であるサンプルを除去した。ロジスティック回帰を行い、共変量として年齢、性別、年齢*年齢、募集中心、プレートを含む3つのCOVID-19アウトカムとの関連標準化されたOAS1レベルを検定した。
報告の概要
研究デザインの詳細については、この記事にリンクされているNature Research Reporting Summaryに掲載されています。
データの利用可能性
参考文献
(※mono...略)
.